Benzol hat verschiedene mesomere Grenzstrukturen, d.h. diese Darstellungsweisen sind einander gleichwertig:
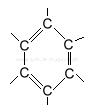 |
 |
 |
 |
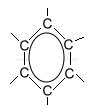 |
Vereinfacht stellt man Benzol üblicherweise folgendermaßen
dar:
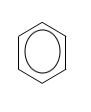 |
Bei dieser Darstellung des Benzols
bedindet sich also in jeder Ecke des Sechsecks ein Kohlenstoffatom.
Jedes Kohlenstoffatom ist mit jeweils einem Wasserstoffatom verbunden.
Sämtliche Atome des Moleküls liegen in einer Ebene. Die
zweite Bindung, die sogenannte pi-Bindung ist delokalisiert, d.h.
man kann ihren Aufenthaltsort nicht klar bestimmen. Somit haben
alle Kohlenstoffatome den gleichen pi-Bindungsanteil und die Ladung
der pi-Elektronenwolke ist überall die gleiche. Jede C-C -Bindung
ist also weder eine einfache sigma Bindung noch eine normale Doppelbindung,
sondern liegt vielmehr zwischen diesen beiden Bindungstypen. |
Aufgrund der besonderen Stabilität des Benzols, die in der Delokalisation seiner sechs pi-Elektronen, der Ausbildung eines zyklischen Molekülorbitals über alle sechs Kohlenstoffatome und der damit verbundene vollständig symmetrischen Elektronenverteilung begründet ist, ist die Halogenierung im Gegensatz zu Cyclohexen nur in Anwesenheit eines Katalysators möglich.
Die Bromierung von Benzol ist eine elektrophile Substitutionsreaktion
und läuft nach folgendem Reaktionsmechanismus ab: