Eine Oxidationslösung (Natriumdichromat +H2O + konz. Schwefelsäure) wird in Cyclohexanol (3C6 H11OH) zugegeben
Beim Umrühren entsteht eine dunkelgrüne Farbe). Nach einiger Zeit entstehen zwei Phasen. Die obere klare Phase ist die org. Phase und die untere dunklere Phase ist die wässrige Phase. Wie kommen diese Phasen zustande welche chem. Vorgänge laufen ab?
Wenn man diese zwei Phasen destilliert wird das Destillat mit Kochsalz gesättigt, die org. Phase wird abgetrennt (Scheidetrichter) , über Natriumsulfat getrocknet und filtriert. Das Filtrat ist dann Cyclohexanon.
|
Folgende Angaben liegen vor:
Bei der Reaktion von Kaliumdichromat mit Cyclohexanol wird der Alkohol zum Keton oxidiert. Dabei entsteht Chrom(III)
Wir versuchen die Reaktionsgleichung nun schrittweise zu erstellen:
| Reduktion: | Cr2O72-
|
Chrom der Oxidationsstufe (VI) geht in Chrom der Oxidationsstufe (III) über. | |
| Oxidation: | 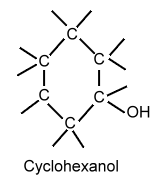 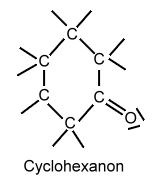 |
Cyclohexanol
geht in Cyclohexanon über. |
Wir gleichen nun mit Elektronen aus...
| Reduktion: | Cr2O72- +
6 e-
|
Da 2 Chromionen jeweils ihre Oxidationsstufe von +VI auf + III verändern , sind auch 2*3 = 6 e- zum Ausgleich notwendig. | ||
Oxdiation: |
  |
+ 2 H+ + 2 e- |
Da sich die Oxidationszahl von 0 auf +II erhöht müssen 2 Elektronen abgegeben werden. |
|
| Reduktion: | Cr2O72- +
6 e- + 14 H+
|
Man sorgt nun mit Wasserstoff-protonen für einen atomaren Ausgleich auf beiden Seiten. 7 Sauerstoffatome verknüpfen sich mit der doppelten Anzahl an H+ zu H2O | ||
| Oxidation: |   |
+ 2 H++ 2 e- /*3 | Wenn aus einem Alkohol ein Keton entsteht, werden 2 Wasserstoffatome pro entstehende Ketongruppe abgegeben. | |
Die Anzahl der abgegebenen und aufgenommenen Elektronen
muss auf beiden Seiten identisch sein...
Daher multiplizieren wir die Oxidationsteilgleichung mit dem Faktor 3.
| Reduktion: | Cr2O72- + 6 e- +
14 H+ |
Wir kontrollieren nun, ob
die Ionen und Ladungen auf der linken und rechten Seite der Reaktionsgleichung
identisch sind. Für die Reduktion gilt z.B: Linke Seite: 2 Chrom-Ionen, 7 Sauerstoff-Ionen, 14 Wasserstoff-Ionen rechte Seite: 2 Chrom-Ionen, 7 Sauerstoff-Ionen, 14 Wasserstoff-Ionen Ladung linke Seite: + 6 rechte Seite: +6 -> alles ok !!! |
Oxidation: |
3  +
6 H++ 6e- +
6 H++ 6e- |
Nun wird die linke und rechte Seite der Reaktionsgleichung
addiert...
Die Elektronen werden nicht mehr aufgelistet,
denn alles, was auf beiden Seiten der Reaktionsgleichung aufgelistet ist,
fällt weg !!
Cr2O72- + 14 H+
+ 3 
 +
6 H+ +
6 H+ |
Da wir sowohl auf der linken als auch auf der
rechten Seite der Reaktionsgleichung noch H+ Ionen haben, werden
6 H+ Ionen auf beiden Seiten gekürzt.
Cr2O72- + 8 H+
+ 3
 |
Möchte man die Redoxgleichung nun in eine
Reaktionsgleichung umwandeln, muss man sich der ursprünglichen Verbingungen
noch einmal bewusst werden. ..
Vernachlässigt
wurden die Kaliumionen und die Sulfationen der beteiligten Schwefelsäure,
die an der Reaktion nicht teilgenommen haben.
Also können wir folgende Gesamtreaktionsgleichung
aufstellen:
Na2Cr2O7 +
4 H2SO4 + 3
 +
Na2SO4 +
Na2SO4
|