Diskurs:
Die Darstellung ist nur eine Momentbetrachtung,
denn in Wirklichkeit kreisen die Elektronen mit unglaublicher Geschwindigkeit
auf bestimmten Bahnen um den winzig kleinen Atomkern herum, der hier deutlich
vergrößert dargestellt wird.Große Erkenntnisse über
den Aufbau des Atoms wurden erst durch die Erfindung des Elektronenmikroskops
möglich.
Diejenigen
Lehrer, welche den Schülern die Darstellungsweise (1) vermitteln,
sehen die Elektronenschale als Aufenthaltsbereich zwischen den schwarzen
Umrandungen.
Vertreter der Darstellungweise (2) fassen die Elektronenschale als schmalen
hier schwarz eingezeichneten Kreis auf, auf welchem sich Elektronen befinden.
Die
Darstellungsweisen (1) und (2) bergen allerdings die Gefahr, dass Schüler
Elektronen lediglich als Punkte wahrnehmen und folglich auch immer nur
von Punkten, nicht aber von Elektronen reden.
Die Darstellungen (3) und (4) wollen diesem Phänomen, dass Elektronen
lediglich als Punkte angesehen werden, entgegen wirken.
Das Modell (5) vernachlässigt zur Vereinfachung völlig die Protonen
und Neutronen, die sich im Kern befinden.
Über die beste Darstellungweise sind die Meinungen sehr verschieden.
Tatsache aber ist, dass die ersten beiden Darstellungweisen am meisten
verbreitet sind. Insofern möchte ich auch bei den folgenden Ausführungen
auf die 1. Darstellungweise zurückgreifen.
Darstellung der Elemente der 1. und 2. Periode
gemäß dem
Bohr´schen Atomodell sowie mit der
verkürzten Lewis-Schreibweise

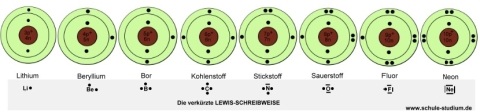
Merke:
- Die Elektronen eines Atoms werden von innen nach außen auf die
Elektronenschalen verteilt.
- Nachdem die erste Schale(k-Schale) mit 2 Elektronen voll besetzt ist,
wird die 2. Schale gleichmäßig gefüllt. Dabei sollte
bei der Darstellung darauf geachtet werden, dass die Elektronen in obiger
Weise systematisch angeordnet werden und nicht willkürlich.
- Die 2. Elektronenschale(l-Schale) kann maximal 8 Elektronen aufnehmen.
- Ab dem 5. Elektron (bei Stickstoff) bilden sich Elektronenpaare.
- Da nur die äußerste Schale(Valenzschale) für chemische
Reaktionen von Bedeutung ist - denn nur dort finden Veränderungen
statt- hat man die verkürzte Lewis-Schreibweise eingeführt.
- Jedes Atom kann so viele Bindungen eingehen, wie es einsame, d.h.
ungepaarte Elektronen hat.
Lithium hat ein einzelnes
Elektron, kann also folglich eine Einfachbindung
mit einem
anderen Reaktionspartner eingehen.
Beryllium hat zwei
einzelne Elektronen, kann also folglich zwei Einfachbindungen mit einem anderen Reaktionspartner eingehen.
usw.
Schon gewußt?
Aus diesem Grund verknüpft
sich auch 1 Fluoratom mit einem Wasserstoffatom zu 1 Molekül HF.
... reagiert auch ein Sauerstoffatom mit zwei
Wasserstoffatomen
zu einem Molekül Wasser(H20)
... sind
die Edelgase wie z.B. Helium & Neon reaktionsträge und gehen
nahezu gar keine Verbindungen ein.
Die maximale Aufnahmekapazität einer Elektronenschale lässt
sich mit folgender Formel errechnen: 2n2, wobei n für
die Schale steht.
Anwendungsbeispiele: 1.
Schale, [k-Schale] (n = 1) 2 * 12 = 2
2.
Schale, [l-Schale] (n = 2) 2 * 22 = 2 * 4
= 8
3.
Schale, [m-Schale] (n = 3) 2 * 32 = 2 * 9 = 18
4.
Schale, [n-Schale] (n = 4) 2* 42 = 32
5.
Schale, [o-Schale] (n = 5) 2* 52 = 50
Doch Vorsicht!
Diese Angaben bedeuten lediglich,
dass die Elektronenschalen maximal soviel Elektronen aufnehmen können, nicht aber, dass sie es auch in jedem
Fall tun.
Es gelten stets die im Menupunkt
´Periodensystem der Elemente´
angesprochenen Grundregeln, denn mit jeder neuen Periode,
wird auch
eine neue Elektronenschale besetzt.
Ein paar Beispiele
zur Erläuterung:
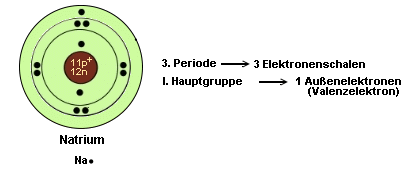
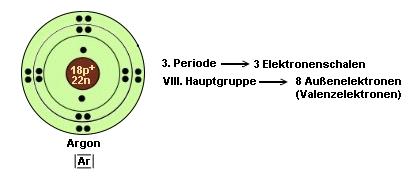
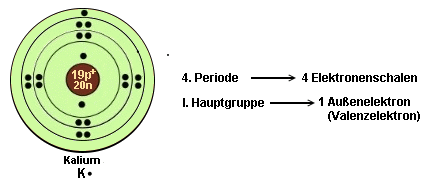
- Atome haben stets das Bestreben, eine vollbesetzte äußere
Elektronenschale zu haben (Oktettregel, Duettregel)
In der 2. Periode hat diesen Zustand nur Neon erreicht. Deshalb bezeichnet
man Elemente der 8. Hauptgruppe auch als Edelgase. Sie sind sehr reaktionsträge
und haben kaum ein Bestreben, Reaktionen einzugehen.
Folglich gehen Atome der 1. Periode Verbindungen ein, die ein Elektronenduett
ermöglichen, während Atome der 2. Periode ein Elektronenoktett
(8 Elektronen auf der äußersten Schale) anstreben.
- Aus diesem Grund kommen zahlreiche Gase im Periodensystem wie z. Wasserstoff
H2, Sauerstoff O2, Stickstoff O2, Fluor
F2, Chlor Cl2, Brom Br2 und Iod I2 nur biatomar, d.h. zweiatomig vor.
|

