MERKE:
Die Elektronenpaarbindung ist
...
eine Bindung zwischen zwei Nichtmetallen.
Das
Periodensystem der Elemente beinhaltet nur wenige Nichtmetalle.
Für
den Chemieunterricht sind eigentlich nur wenige wirklich relevant:
sowie die Halogene
|
Chemie Interaktiv
lehren, lernen und üben
|
Es gibt 2 Arten der Elektronenpaarbindung nämlich
a) die unpolare Elektronenpaarbindung(zwischen
zwei identischen Nichtmetall-Atomen eines Elements
)
z.B. Wasserstoff-Wasserstoff, Sauerstoff-Sauerstoff,
Stickstoff-Stickstoff etc.) |
Da Elemente wie Wasserstoff, Sauerstoff, Stickstoff sowie die Halogene
Fluor, Chlor, Brom und Iod in der Natur immer biatomar, d.h. 2 Atome
sind immer miteinander verbunden, vorkommen bezeichnet man diese
auch als biatomare Elemente
Die biatomaren Moleküle
|
| |
Wasserstoff:
Ordnungszahl :1 -> 1 Proton,
1 Elektron
Atommasse: 1 -> 0
Neutronen
1. Periode:
-> 1
Elektronenschale
1. Hauptgruppe ->
1 Außenelektron
Hinweis:
Außenelektronen(Valenzelektronen) sind die Elektronen auf
der äußersten Schale. |
 |
| |
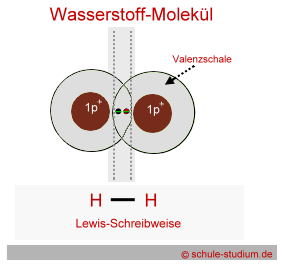
Wasserstoff befindet
sich in der 1. Hauptgruppe. Da er nach einer vollbesetzten äußeren
Schale strebt (2 Elektronen auf k-Schale), aber nur ein Außenelektron
hat, verbinden sich in der Natur zwei Wasserstoffatome zu dem
Wassermolekül. Man schreibt H2.
Dargestellt ist der Überlappung der Elektronenräume
zweier Wasserstoffatome. Durch diese gegenseitige Durchdringung
der Elektronenräume stehen nun beiden Wasserstoffatomen
2 Außenelektronen zur Verfügung.
Die Duettregel, die besagt, dass
Atome der 1. Periode 2 Außenelektronen anstreben, ist
damit erfüllt.
Liegen mehrere Wassermoleküle vor, so schreibt man 2 H2,
3 H2, 4 H2, 5 H2 etc.
Wichtig: Niemals wird der tiefgestellte
Index 2 verändert!! |
|
| |
Ordnungszahl : 8 -> 8
Protonen, 8 Elektronen
Atommasse: 16 -> 8
Neutronen
2 . Periode:
-> 2
Elektronenschalen
6. Hauptgruppe ->
6 Außenelektronen
Hinweise:
Außenelektronen (Valenzelektronen) sind die Elektronen auf der
äußersten Schale.
Subtrahiert man die Ordnungszahl von der Atommasse, so erhält
man die Anzahl der Neutronen im Kern !!! |
 |
| |
Sauerstoff
befindet sich in der 6. Hauptgruppe. Da er nach einer vollbesetzten
äußeren Schale strebt (8 Elektronen auf l-Schale),
aber nur 6 Außenelektronen hat, verbinden sich in der
Natur zwei Sauerstoffatome zu dem Sauerstoffmolekül.
Man schreibt O2.
Dargestellt ist der Überlappung der Elektronenräume
zweier Sauerstoffatome. Durch diese gegenseitige Durchdringung
der Elektronenräume stehen nun beiden Sauerstoffatomen
8 Außenelektronen zur Verfügung.
Die Oktettregel, welche besagt, dass jedes Element
der 2. Periode ein Elektronenoktett anstrebt, ist somit erfüllt.
|
|
|
| |
Ordnungszahl : 7 -> 7
Protonen, 7Elektronen
Atommasse: 14 -> 7Neutronen
2 . Periode:
-> 2
Elektronenschalen
5 . Hauptgruppe ->
5 Außenelektronen
Hinweise:
Außenelektronen (Valenzelektronen) sind die Elektronen auf der
äußersten Schale.
Subtrahiert man die Ordnungszahl von der Atommasse, so erhält
man die Anzahl der Neutronen im Kern !!! |
 |
| |
Stickstoff
befindet sich in der 5. Hauptgruppe. Da er nach einer vollbesetzten
äußeren Schale strebt (8 Elektronen auf der l-Schale),
aber nur 5 Außenelektronen hat, verbinden sich in
der Natur zwei Stickstoffatome zu dem Stickstoffmolekül.
Man schreibt N2.
Dargestellt ist der Überlappung der Elektronenräume
zweier Stickstoffatome. Durch diese gegenseitige Durchdringung
der Elektronenräume stehen nun beiden Stickstoffatomen
8 Außenelektronen zur Verfügung.
Die Oktettregel, welche besagt, dass jedes Element
der 2. Periode ein Elektronenoktett anstrebt, ist somit
erfüllt.
Häufige Frage: Woher
weiß man, wieviele Elektronen sich in der Schnittmenge
befinden?
Antwort: Recht einfach....
Ist ein Element in der 5. Haupgruppe, so fehlen ihm bis
zum Oktett 3 Elektronen, diese 3 Elektronen bringen beide
Atome in die Schnittmenge ein. Folglich befinden sich 6
Elektronen in der Schnittmenge.
Ist
ein Element in der 6. Hauptgruppe, so fehlen ihm bis zum
Oktett ___ Elektronen, diese ___ Elektronen bringen beiden
Atome in die Schnittmenge ein. Foglich befinden sich ___
in der Schnittmenge.
nachgedacht?
Lösung: genau 2..., 2... . Folglich befinden sich 4
... in der Schnittmenge.
|
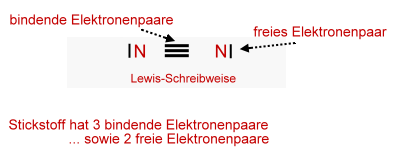
Merke:
Elektronen in der Schnittmenge bezeichnet man als
bindende
Elektronenpaare;
Elektronenpaare, außerhalb
dieser Schnittmenge bezeichnet man als
freie
Elektronenpaare.
|
| |
b) die polare Elektronenpaarbindung
(zwischen zwei unterschiedlichen Nichtmetall-Atomen verschiedener
Elemente)
|
|
|

