| Gemäß Pauling ergeben sich Ionenbindungen bei einer Elektronegativitätsdifferenz
der
Partner von  EN>
1,7 EN>
1,7
Elektonegativitäten
nach Pauling:
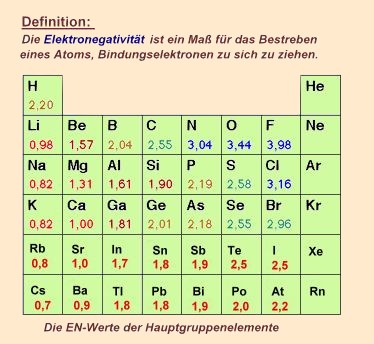
Nehmen wir das Beispiel: Natriumchlorid.
EN Na: 0,82
EN Cl : 3,16
Die  EN
=2,34 und liegt höher als der Grenzwert ( EN
=2,34 und liegt höher als der Grenzwert (  EN> 1,7) EN> 1,7)
Folglich handelt es sich bei Natriumchlorid um eine Ionenbindung
Werfen wir nun einmal einen Blick auf
die Entstehung einer Ionenbindung(Salzbildung):
1. Schritt: Die
Bildung des Metallkations:
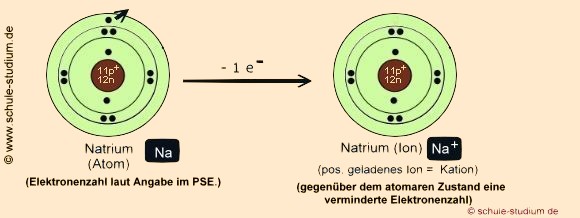
Das Metall Natrium mit einer geringen EN, d.h. einem niedrigen Bestreben,
Elektronen einer benachbarten Bindung zu sich zu ziehen, gibt sein Außenelektron
( Valenzelektron) ab, um den energiearmen und stabilen Edelgaszustand
von Neon zu erreichen.
Natrium erreicht den Edelgaszustand von Neon, indem es einfach seine äußerste
Elektronenschale aufgibt und somit nur noch zwei besetzte Schalen aufweist.
Merke:
In einer Ionenbindung ist es grundsätzlich das Metall, das Elektronen
abgibt.
Für jedes abgegebene Elektron erhält das Ion eine
positive Ladung, d.h.
- 1 e--> Me +
- 2 e--> Me 2+
- 3 e--> Me 3+
´Me´ steht allgemein für ein Metall
!!
© www.schule-studium.de |
2.
Schritt: Die Bildung des Nichtmetall-Anions Chlorid:
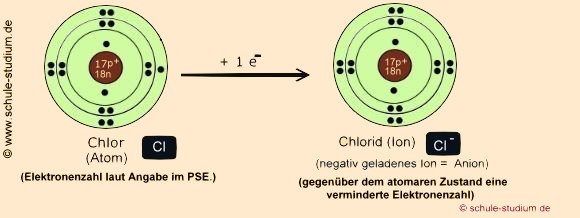
Das Nichtmetall( hier Halogen) ist elektronegativer(EN
Cl : 3,16) und hat ein großes Bestreben, Elektronen
zu sich zu ziehen.
Es nimmt ein Elektron auf, um ebenso den Edelgaszustand(vollbesetzte
äußere Schale) zu erreichen.
Merke:
In einer Ionenbindung ist es grundsätzlich das Nichtmetall, das
Elektronen aufnimmt. Für jedes aufgenommene Elektron erhält
das Ion eine negative Ladung, d.h.
+ 1 e-->
Hal - (Halogene nehmen 1 Elektron auf !!
, VII. Hauptgruppe, es fehlt 1 e zum Oktett)
+ 2 e--> O2-, S2-
(Sauerstoff und Schwefel nehmen 2 Elektronen auf; VI. Hauptgruppe,
es fehlen noch 2e zum Oktett.)
´Hal´ steht allgemein für ein Halogen
(Fluor, Chlor, Brom, Iod) !!
Halogene werden auch als Salzbildner bezeichnet.
© www.schulestudium.de |
Energetisch laufen folgende Schritte ab, bis
schließlich eine Ionenbindung erfolgt.
1. Aufspaltung
des Chlormoleküls in zwei einzelne Chloratome.(Energie wird benötigt)
2. Überführung des Natriums vom festen in den gasförmigen
Zustand(Energie wird benötigt)
3. Überführung des Natrium-Atoms in ein Natrium-Ion. (Energie
wird benötigt)
4. Überführung des Chlor-Atoms in ein Chloridanion.(Energie
wird frei)
5. Verbindung der beiden Ionen Na+ und Cl -
zu Natriumchlorid (Kochsalz)
Vorgang |
Energie (endotherm/exotherm) |
Energietyp |
Cl2(g)  2
Cl(g) 2
Cl(g) |
+ 
H
+ 121 KJ/mol |
Dissoziationsenergie |
Na (s)  Na
(g) Na
(g) |
+ 
H
+ 109 KJ/mol |
Sublimierungsenergie |
Na(g)  Na+
(g) Na+
(g) |
+ 
H
+ 502 KJ/mol |
Ionisierungsenergie |
Cl (g)  Cl-
(g) Cl-
(g) |
+ 
H
- 365 KJ/mol |
Elektronenaffinität |
Na+ (g) + Cl- (g) NaCl(s) NaCl(s) |
+ 
H
- 778 KJ/mol |
Gitterenergie
|
| Gesamtenergiebilanz:
|
-
411 KJ /mol |
|
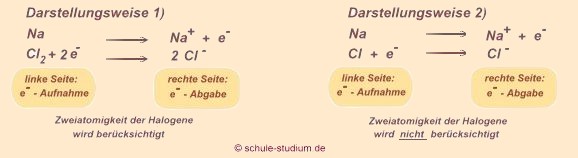
Die Bindung von Natrium und Chlor sieht nun wie
folgt aus:
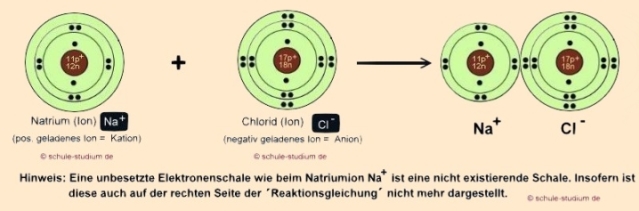
Der Chemiker schreibt diesen Ablauf in folgender Reaktionsgleichung
(siehe auch Redoxreaktion)
Weitere Informationen auf dem Schulportal:
-> Atome werden Ionen
-> Formeln von Salzen
-> Stichwortverzeichnis,
Ionenbindung
Weiterführende externe Links zum Thema Ionenbindung:
Ionenbindung
(u-helmich.de)
Ernst G. Beck, Chemie- und Biologielehrer:
Ionenbindung, Kochsalz, Röntgenstrukturanalyse, Kristallstrukturen, Bindungsenergie, Lewis-Formeln,
Eigenschaften
von Ionenverbindungen, Nomenklatur, Bildung von Ionen als
Redoxreaktion
|


