|
Sind Metalle Witterungseinflüssen ausgesetzt, wie
in Abb. 1, so kommt es zu hässlichen Veränderungen des Metalls.
Allgemein spricht man bei dieser elektrochemischen Reaktion von Korrosion.
Beim Eisen spricht man oft auch einfach von Rosten. Man unterscheidet
eine Flächenkorrosion mit nahezu gleichmäßiger Korrosion
sowie die Lochkorrosion(Lochfraß), welche nur an einer kleinen
Fläche des Metalls abläuft. |
Das Rosten von Eisen
lässt sich in folgenden Reaktionsgleichungen beschreiben:
Lokal-Anode: Fe Fe
2+ + 2e - Oxidation (Elektronenabgabe) /*2 Fe
2+ + 2e - Oxidation (Elektronenabgabe) /*2
Elementares Eisen(Atom) geht über in das Eisen(II)-Ion.
Dabei werden
2 Elektronen abgegeben.
Lokal-Kathode: O2+
2 H2O + 4 e- 4
OH - 4
OH -
Reduktion (Elektronenaufnahme)
1 Molekül elementarer Sauerstoff verbindet sich mit 2 Molekülen
Wasser zu 4 Hydroxidionen (OH-) Ionen. Dabei werden 4 Elektronen
aufgenommen.
Da bei der ersten Reaktion allerdings nur 2 Elektronen abgegeben werden
und bei der Kathodenreaktion 4 Elektronen benötigt werden, muss die
Anodenreaktion zweimal ablaufen. Wir multiplizieren die Anodenreaktion folglich
mit dem Faktor 2 und schreiben ´ /*2 ´
Lokal-Anode: 2 Fe 2
Fe 2+ + 4 e - Oxidation 2
Fe 2+ + 4 e - Oxidation
(Elektronenabgabe)
Elementares Eisen(Atom) geht über in das Eisen(II)-Ion. Dabei werden
2 Elektronen abgegeben.
Lokal-Kathode: O2+
2 H2O + 4 e- 4
OH - 4
OH -
Reduktion (Elektronenaufnahme)
Nun werden bei der Anodenreaktion 4 Elektronen abgegeben und bei der
Kathodenreaktion 4 Elektronen aufgenommen, die zur Bildung von 4 Hydroxidionen
benötigt werden.
Stoßen Fe 2+ nun auf Hydroxidionen ( OH - )
so entsteht schwerlösliches Eisen(II)-hydroxid, das durch Sauerstoff
zu rotbraunem Eisen(III)oxid-hydroxid (Rost) oxidert wird.
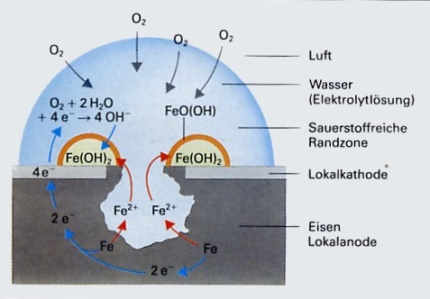
Fe2++
2OH - Fe(OH)2 Fe(OH)2
4
Fe(OH)2 + O2 4
FeO(OH) + 2 H2O 4
FeO(OH) + 2 H2O
Eisen(III)-oxid-hydroxid bezeichnet man in der Fachsprache
als Rost.
|

